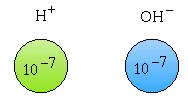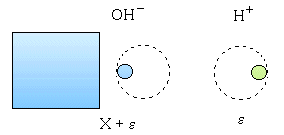| EQUILIBRE DE DISSOCIATION DE L’EAU | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Les concentrations [ ] sont exprimées en mole/l |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Produit ionique de l’eau | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| La molécule d’eau se dissocie partiellement suivant la réaction :
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Milieu acide, milieu basique |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
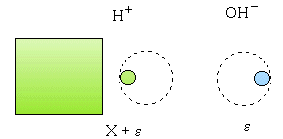
Milieu acide : Ajoutons X mole de H+ à un litre d’eau pure : L’équilibre de dissociation de l’eau évolue dans le sens de la formation de H2O.
Si X < 10-6 : équation du second degré en e . Si X > 10-6 , e devient négligeable devant X
Milieu basique : Ajoutons X mole de OH- à un litre d’eau pure : L’équilibre de dissociation de l’eau évolue dans le sens de la formation de H2O.
Si X < 10-6 : équation du second degré en e . Si X > 10-6 , e devient négligeable devant X
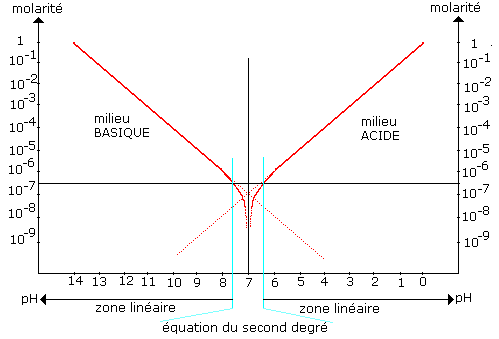
Pour les concentrations très faibles (<10-6) l’évolution du pH n’est plus linéaire
Acides, bases, couples acide-base Coefficient de dissociation (a ), coefficient d’hydrolyse (b ) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||