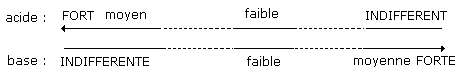coefficient
de dissociation (a ),
coefficient d’hydrolyse (b ) |
| |
| Dissociation
d’un acide AH |
|
|
AH |
<-------> |
A- |
+ |
H+ |
| [ ] départ |
C0 |
|
0 |
|
0 |
| [ ] équilibre |
C0.(1- a ) |
|
C0.a |
|
C0.a |
a représente la fraction de AH dissociée. Ka =
C0.a 2 / (1-a
) |
| Hydrolyse
d’une base A- |
|
|
A- |
+ |
H2O |
<-------> |
AH |
+ |
OH- |
| [ ] départ |
C0 |
|
|
|
0 |
|
0 |
| [ ] équilibre |
C0.(1- b ) |
|
|
|
C0.b |
|
C0.b |
b représente la fraction de A- hydrolysée. . Kb
= C0.b 2 / (1-b
) |
| Composés forts,
moyens, faibles, indifférents |
|
| |
fort |
moyen |
faible |
indifférent |
| Acides |
a = 1 |
0,1< a < 1 |
a < 0,1 |
a = 0 |
| Ka ® ¥ |
Ka > 10-2 |
Ka <
10-2 |
Ka = 0 |
| |
|
|
|
|
| Bases |
b = 1 |
0,1< b < 1 |
b < 0,1 |
b = 0 |
| Kb ® ¥ |
Kb > 10-2 |
Kb <
10-2 |
Kb = 0 |
Remarques :
- La force d’un acide et de sa base conjuguée varient en sens opposé :
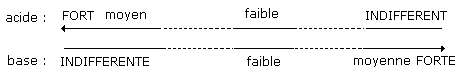
- Si les composés ne sont pas trop faibles (a
ou b très petits) ou pas trop dilués (C0
très petit) alors la dissociation de l’eau est négligeable.
[H+] @ [H+]acide
= C0.a de même [OH-]
@ [OH-]base = C0.b
- Pour les composés faibles a et
b sont petits devant 1.
De ce fait Ka @ C0.a
2 pour les acides et Kb @ C0.b 2 pour les bases ou encore :
a @ (Ka/C0)1/2
pour les acides et b @ (Kb/C0)1/2
pour les bases
La dissociation et l’hydrolyse augmentent avec la dilution.
- Les hydroxydes alcalins sont des bases fortes (NaOH, KOH,…)
- Les acides organiques sont faibles.
- Pour mettre en solution une base faible seule (A-), il suffit de mettre en
solution un sel alcalin :
(NaA ----------> Na+ + A-) puisque le
métal est un acide indifférent !
- HCl, HBr, HI, H2SO4, HClO4, HNO3 sont des
acides forts.
RETOUR |
|
|
|