| Les potentiels indiqués dans les tables sont potentiels standards (E0ox
ou E0red).
L’équation de Nernst permet de calculer les potentiels dans les conditions
non-standards :
a A + b B <---------> g
C + d D + ne |
|
|
|
|
|
(aC)g. (aD)d |
Eox = |
E0ox – (0,06 / n). log |
------------ |
|
|
(aA)a. (aB)b |
| g C + d D + ne <---------> a A + b B |
|
|
|
|
|
(aA)a. (aB)b |
Ered = |
E0red – (0,06 / n) .
log |
------------ |
|
|
(aC)g.(aD)d |
aX désigne l’activité du composé X :
état physique
de X |
X en solution |
X solide |
X gazeux |
a X |
[X] en
mole/l |
1 |
PX
en atmosphère |
exemples :
| Al <---------> Al+++ + 3e |
Eox = E0ox – 0,02 . log [Al+++] |
| H2 <---------> 2 H+
+ 2e |
Eox = E0ox – 0,03 . log ([H+]2/PH2) |
| Sn++ <---------> Sn++++
+ 2e |
Eox = E0ox – 0,02 . log ([Sn++++]/[Sn++]) |
Mesure des potentiels standards.
Ne pouvant mesurer que des DDP, on a fixé arbitrairement à 0 le potentiel
standard de l’électrode à hydrogène, les autres potentiels sont déterminés par
mesure de la DDP avec cette électrode.
Prévision des réactions.
La position relative de 2 couples dans l’échelle des potentiels peut
renseigner sur la spontanéité d’une réaction redox :
Le zinc est attaqué par tous les acides ; le cuivre ne l’est que par
l’acide nitrique.
En cas de compétition entre différentes espèces, il y a :
oxydation de l’espèce la
plus oxydable (Eox max)
réduction de l’espèce la plus réductible (Ered max).
Electrodes de référence.
L’électrode à hydrogène n’est pas commode d’emploi. On lui
préfère :
l’électrode d’argent Ag/AgCl/Cl- |
l’électrode au calomel Pt/Hg/Hg2Cl2/Cl- |
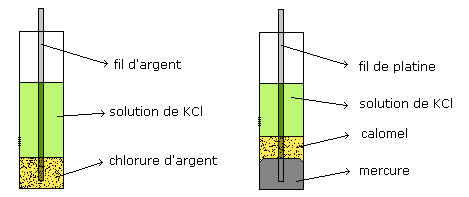
dont les potentiels sont très stables.
Dans les 2 cas on montre facilement que le potentiel d’électrode dépend
uniquement de la concentration en Cl-.
Si cette concentration est importante, elle peut être considérée comme constante dans
une utilisation analytique des éléctrodes.
Applications.
mesures de concentrations, dosages.
La dépendance qui existe entre concentration et potentiel d’électrode permet
d’effectuer de nombreux dosages par la mesure de ce potentiel par rapport à une
électrode de référence.
potentiométrie.
On peut suivre un dosage redox en mesurant le potentiel que prend une électrode de
platine plongeant dans le mélange par rapport à une électrode de référence : red1
+ ox2 <---------> ox1 + red2
Kc
A tout instant les potentiels imposés à l’électrode de platine par les 2 couples
red1/ox1 et red2/ox2 sont identiques.
Cette égalité permet de calculer Kc et d’en déduire si la réaction
peut être considérée comme quantitative ou non.
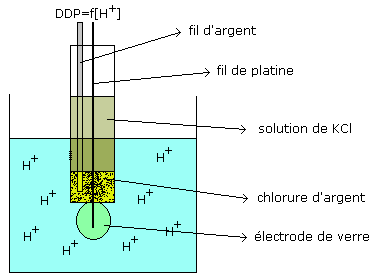
mesure du pH
on utilise une électrode dite " combinée " c’est-à-dire qui
associe une électrode de référence (chlorure d’argent) à une électrode de verre
dont le potentiel dépend de la concentration en ions H+ dans la solution de
mesure.
pile de concentration : cette pile est constituée de
2 demi-piles de même nature mais dont les concentrations sont différentes :
| exemple : Ag / Ag+ // Ag+ /Ag |
FEM = 0,06.log([Ag1+]/[Ag2+]) |
Piles et
accumulateurs
Corrosion
Electrolyse
Exercices
|